Connexion covalente
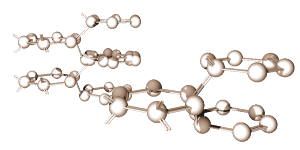
Figure 1 : Structure cristalline typique.
Connexion covalente
Les propriétés chimiques d’un élément dépendent du nombre d’électrons de valence dans son orbite externe. Quand la couche est pleine, l’atome est stable et réagit peu avec les autres atomes pour former des composés et des solides. Seuls les atomes ayant huit électrons de valence ont une couche complète et sont qualifiés d’inertes ou inactifs. Si la couche n’est pas pleine, l’atome aura tendance à se joindre à d’autres atomes pour partager leurs électrons afin d’être plus stable.
Par exemple, le silicium et le germanium sont éléments les plus fréquemment utilisés dans les semi-conducteurs. Ils font partie de la même famille chimique avec quatre électrons de valence. Les deux doivent partager quatre électrons avec un ou plusieurs atomes dans un lien de covalence pour stabiliser leur couche externe. Par conséquent, les atomes du germanium ou du silicium se placeront dans une structure très rigide en trois dimensions pour ce partage, formant un cristal.
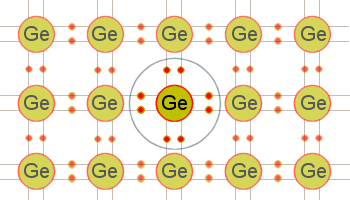
Figure 2 : Vue transversale du réseau cristallin cubique de germanium.
La figure 2 montre un réseau cristallin de germanium où les grosses sphères représentent un atome, les petites sphères les électrons de valence et les « bras » qui les joignent les liens covalents. Il est extrêmement difficile de briser les liens dans ce cristal de germanium parce que chaque atome est lié à quatre autres atomes. Les électrons ne peuvent se mouvoir facilement dans ce réseau et le germanium est donc un mauvais conducteur. Le silicium a une structure identique.
Ces deux éléments ne sont cependant pas des isolants car en appliquant un niveau approprié de réchauffement ou de tension électrique, les électrons peuvent s’affranchir de leur lien covalent et passer dans la bande de conduction. Une fois passés dans celle-ci, ils peuvent errer dans le cristal.
